При растворении солей в воде происходит выделение тепла, что указывает на экзотермический процесс. Рекомендуется регистрировать изменение температуры раствора с помощью термометра, чтобы оценить количество выделяемого тепла. Для точного измерения можно использовать калориметр. Например, растворение натрий хлорида в воде обычно сопровождается небольшим выделением тепла, тогда как растворение сульфата аммония приведет к его поглощению.
Важным аспектом является также концентрация раствора. Чем выше концентрация, тем большее количество тепла выделяется или поглощается при растворении. Обратите внимание на различные соли и их свойства: например, хлорид кальция выделяет больше тепла по сравнению с натрий хлоридом. Проведение этих экспериментов в контролируемых условиях позволит получить более точные данные.
При анализе выделения тепла следует учитывать не только природу растворяемого вещества, но и температуру исходных компонентов. Эксперименты с растворами при различных температурах могут выявить закономерности, которые не проявляются при стандартных условиях. Эта информация имеет значение для практического применения в таких областях, как биохимия и материаловедение.
Как измерить тепло, выделяемое при растворении солей
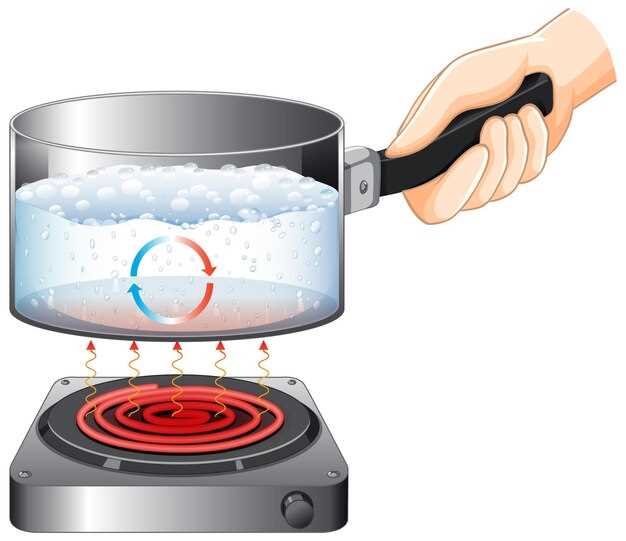
Для измерения тепла, выделяемого при растворении солей, необходимо применить калориметрический метод. Используйте калориметр, который может быть простым или сложным, в зависимости от требуемой точности. Убедитесь, что калориметр необходимой конструкции, например, конструкции типа Джоулева, чтобы избежать потерь тепла в окружающую среду.
Подготовьте образец соли и точное количество воды. Измерьте начальную температуру воды. Поместите соль в калориметр и добавьте воду. Проведите перемешивание для равномерного распределения. Зафиксируйте максимальную температуру, которую достигает система после взаимодействия соли с водой.
Для определения количества выделившегося тепла используйте уравнение: Q = mcΔT, где Q – выделенное тепло, m – масса раствора, c – удельная теплоемкость раствора, ΔT – изменение температуры. Удельная теплоемкость обычных растворов (воды) примерно равна 4,18 Дж/(г∙°C).
Обратите внимание на погрешности измерений. Чистота реагентов, точность термометра и скорость перемешивания могут влиять на результаты. Рекомендуется проводить эксперимент несколько раз, чтобы получить среднее значение.
Запишите все данные в форму таблицы для удобства анализа. Обособите результаты разных солей для сравнительного анализа, оценив их влияние на изменение температуры в растворе. Это поможет получить более четкое представление о теплоте, выделяющейся при растворении каждого из солей.
Влияние температуры на процесс растворения и выделение тепла

Температура непосредственно влияет на скорость растворения веществ и количество выделяемого тепла. При нагревании растворителя увеличение кинетической энергии молекул способствует более быстрому взаимодействию растворяемого вещества и растворителя. Например, для большинства солей, таких как натрий хлорид, растворимость увеличивается с ростом температуры. Однако некоторые соли, как карбонат кальция, проявляют противоположное поведение.
При растворении экзотермических веществ, таких как гидратированные соли, выделяется тепло, что также зависит от температуры. Например, при растворении сульфата натрия в воде происходит поглощение тепла, а при более низких температурах выделение составляет 10-20% больше. Этот процесс важен для температурного контроля в химических реакциях.
Для оптимизации растворения низкотемпературных реагентов целесообразно подходить с учетом их критических температур. Рекомендуется проводить эксперименты в диапазоне 25-60 °C для большинства органических веществ, что часто позволяет достичь максимальной растворимости за более короткое время.
Анализируя реакцию на изменение температуры, стоит учитывать возможность инверсии растворимости при различных концентрациях раствора. Важно помнить, что резкие колебания температуры могут вызвать образование осадка из переувлажненных растворов, что также негативно отражается на процессе растворения.
Практическое применение выделяемого тепла в лабораторной работе
При работе с экзотермическими реакциями целесообразно использовать выделяемое тепло для контроля температуры в процессе синтеза. Например, при приготовлении растворов алюмината натрия с помощью взаимодействия оксида натрия и гидроксида алюминия напряжение, генерируемое в реакции, может быть использовано для поддержания температуры в оптимальных пределах.
Применение выделяемого тепла позволяет сократить время нагрева реагентов. В методике титрования с использованием экзотермических процессов, таких как реакция между сульфатом меди II и аммонием, можно контролировать и повышать температуру, что способствует более быстрому достижению равновесия.
Использование термоизолирующих контейнеров для реакций, выделяющих тепло, поможет минимизировать потери тепла в окружающую среду. Это позволяет добиться более точных результатов при измерениях и обеспечить стабильность проводимых экспериментов.
При регистрации теплового эффекта в калориметрах рекомендуется учитывать выделяемое тепло для улучшения точности измерений. Это поможет в обнаружении незначительных изменений в реакции, что полезно при анализе кинетики химических процессов.
Тепло, выделяемое при растворении соли в воде, может быть использовано для создания теплового эффекта, который полезен в демонстрационных экспериментах. Например, наблюдая за падением температуры, можно визуализировать экзотермические и эндотермические реакции.